La biodiversité au niveau moléculaire et génétique
La biodiversité qu’on observe à l’échelle d’un écosystème est en fait le résultat de mécanismes d’évolution et de sélection qui s’appliquent à tous les niveaux : de la molécule…à l’écosystème. La biodiversité s’observe donc aussi au niveau moléculaire comme en témoignent ces deux exemples sur les ARN et les flavoprotéines.
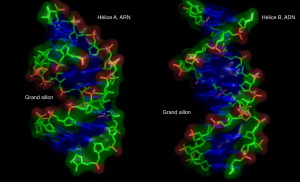
L’ARN, une molécule qui s’est diversifiée au cours de l’évolution ?
La molécule d’ARN (acide ribonucléique) se différencie de l’ADN (acide désoxyribonucléique) par la présence d’un sucre ribose là où l’ADN possède un désoxyribose. Cette petite différence rend l’ARN capable de se replier de façon plus compacte que l’ADN, d’interagir avec d’autres molécules et de catalyser des réactions chimiques de la cellule. Avec le développement de la génomique, le monde des ARN commence à se révéler dans toute sa diversité. Un gène d’ARN peut être transmis linéairement d’une espèce ancestrale à ses descendants. Dans ce cas, la diversité est assez limitée car ce sont tous des ARN homologues de même fonction. Mais il peut aussi être dupliqué. La deuxième copie peut alors être maintenue, perdue, ou acquérir des caractéristiques légèrement différentes de l’originale. Ces duplications ont lieu au cours d’«accidents» qui peuvent concerner des chromosomes entiers, des segments de chromosome ou des transposons (gènes qui «sautent» à différents endroits du génome). Mais les duplications de gènes n’expliquent pas toute la diversité observée. D’autres événements importants interviennent. Certains ARN jouent un rôle de régulateurs de la transcription. Lorsqu’on regarde la séquence d’un gène particulier dans différentes espèces de bactéries, on peut déterminer différents groupes en fonction du type d’ARN régulateur du gène. Il ne s’agit plus d’un gène ancestral qui se retrouve un peu modifié chez les individus actuels mais de molécules et de mécanismes complètement différents avec une même fonction régulatrice. Pour l’expliquer, on pourrait imaginer une série de muta-encotions, mais des événements plus brutaux peuvent avoir lieu comme des transferts horizontaux, des transpositions de segments de génome ou l’invention pure et simple d’un ARN. Chaque génome est une usine à fabriquer de l’ARN en permanence. On pense actuellement que 50 à 90 % du génome humain s’exprime sous forme d’ARN alors que 2 % seulement est codant. A partir de cette synthèse où tous les ARN ne sont pas forcément fonctionnels dès le départ, il peut y avoir des mutations suivies d’une sélection. La transcription de fond serait donc le banc d’essai pour fabriquer de nouveaux ARN.
Contact
Daniel Gautheret
UFR SCIENCES
IGM (Institut de Génétique Moléculaire)
Email : daniel.gautheret@igmors.u-psud.fr
Tel : 01 69 15 62 14
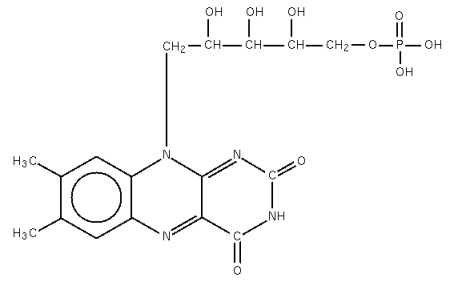
L’exemple des flavoprotéines
Notre corps utilise de nombreuses protéines possédant une activité catalytique, ou enzymes, pour son fonctionnement. Certains de ces enzymes ont besoin de s’associer à d’autres molécules pour être actives. C’est le cas des flavoprotéines qui ne fonctionnent qu’avec de petites molécules, les flavines. Les flavoprotéines sont identifiées chez tous les organismes vivants de la bactérie à l’homme. Chez les bactéries, les gènes qui codent pour des flavoprotéines représentent jusqu’à 4 % de tous les gènes, ce qui donne une idée de l’importance de ces molécules. Chez l’homme, les flavoprotéines jouent aussi un rôle essentiel, bien qu’il ne soit pas capable de réaliser la synthèse des flavines. Il doit trouver ces dernières dans son alimentation sous forme d’une vitamine, la vitamine B2 ou riboflavine que l’on trouve dans de nombreux aliments comme la viande ou les laitages. Dans le foie et les cellules de l’intestin la riboflavine est transformée en FMN (Flavine MonoNucléotide) et en FAD (Flavine Adénine Dinucléotide), molécules qui seront utilisées pour la synthèse de flavoprotéines.
Les flavoprotéines catalysent des réactions extrêmement variées. On les classe en « clans » selon le repliement qu’elles adoptent. A l’intérieur de ces clans, les protéines sont divisées en familles auxquelles correspondent des fonctions différentes. A l’intérieur d’une même famille, les variations de repliements, dits aussi structures tridimensionnelles, sont faibles. On peut classer les familles selon le type de donneurs d’électrons (unique ou multiples) et le type d’accepteurs d’électrons (là encore, unique comme l’oxygène ou multiples). Ces enzymes interviennent dans des fonctions biologiques extrêmement diverses : biosynthèse de toutes sortes de métabolites, détoxification de composés étrangers et toxiques pour la cellule, (les xénobiotiques) par leur réaction avec les cytochromes P450, qui aussi participent à la biosynthèse de produits naturels dont les hormones sexuelles. Les flavoprotéines interviennent encore dans la respiration cellulaire à travers leur présence dans les chaînes de transporteurs d’électrons des membranes des mitochondries, dans l’équilibre rédox de la cellule, dans l’immunité non spécifique à travers la NADPH oxydase en réponse à une infection bactérienne, dans le système nerveux, dans le repliement des protéines etc. De plus, les flavoprotéines sont sensibles à la lumière. Elles peuvent catalyser la réparation de certaines lésions de l’ADN abîmé par la lumière, et servent également de photorécepteurs à lumière bleue, comme les cryptochromes ou les phototropines, impliqués par exemple dans la régulation des rythmes circadiens (rythmes de l’alternance jour/nuit). La liste est longue… De par l’extrême diversité des molécules qu’elles contribuent à synthétiser, et de par l’extrême diversité de leurs fonctions physiologiques, les flavoprotéines participent largement à la biodiversité au niveau moléculaire.
Contact
FLORENCE LEDERER
UFR SCIENCES
LCP (Laboratoire de Chimie Physique)
Email: florence.lederer@u-psud.fr
Tel : 01 69 15 56 12